quinta-feira, 17 de outubro de 2024
domingo, 13 de outubro de 2024
Os erros inatos do metabolismo e a Genética
Aberrações Cromossômicas Estruturais
Aneuploidias Autossômicas
Aneuploidias dos Cromossomos sexuais
Aberraçãoes Cromossômicas
Pleiotropia
Herança Quantitativa
Interação de Genes Não Alelos
Epistasia
LINKAGE
A Relação da Meiose e a Segunda Lei de Mendel.
A Segunda Lei de Mendel, também conhecida como Lei da Segregação Independente, afirma que os alelos de diferentes genes segregam de forma independente uns dos outros durante a formação dos gametas. Isso significa que a herança de um par de alelos não afeta a herança de outro par de alelos, desde que os genes envolvidos estejam em cromossomos diferentes (não ligados).
Essa lei está diretamente relacionada ao processo de meiose, que é a divisão celular que dá origem aos gametas (espermatozoides e óvulos) em organismos sexuados. Para entender essa relação, é importante considerar o comportamento dos cromossomos durante a meiose.
2°LEI DE MENDEL
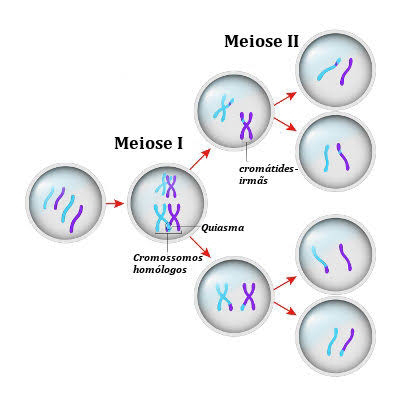
MEIOSE
Relação entre a Segunda Lei de Mendel e a Meiose:
Meiose e Segregação dos Alelos: Durante a meiose, os pares de cromossomos homólogos (que possuem os mesmos genes, mas podem ter alelos diferentes) se alinham no plano equatorial da célula e são segregados aleatoriamente para diferentes células-filhas durante a meiose I. Cada gameta recebe um cromossomo de cada par, ou seja, um alelo de cada gene.
Essa segregação dos cromossomos homólogos é o que fundamenta a primeira lei de Mendel (lei da segregação), já que alelos de um mesmo gene (presentes em cromossomos homólogos) são separados durante a formação dos gametas.
Segregação Independente dos Genes:
A segunda lei de Mendel ocorre porque, durante a meiose I, os pares de cromossomos homólogos se alinham de forma independente na placa metafásica. Assim, a separação de um par de cromossomos (e seus alelos) é independente da separação de outro par.
Isso implica que a combinação de alelos para dois genes diferentes será distribuída de forma independente para os gametas, resultando em uma variedade de combinações genéticas.
Crossing-over e Exceções:
O processo de crossing-over (ou permutação), que ocorre na prófase I da meiose, pode gerar uma mistura adicional de material genético, aumentando a variabilidade genética. No entanto, o crossing-over pode ocorrer entre genes que estão próximos no mesmo cromossomo, o que pode levar à recombinação e não à segregação completamente independente, o que é uma exceção à segunda lei de Mendel. Esses genes são chamados de ligados.
Exemplo Prático:
Mendel estudou a segregação de dois genes que influenciavam a cor e a textura das sementes de ervilhas. Ele observou que o alelo para semente amarela (A) segregava de forma independente do alelo para textura lisa (B), resultando em várias combinações nos descendentes: sementes amarelas e lisas, amarelas e rugosas, verdes e lisas, verdes e rugosas. Esse comportamento corresponde ao que acontece durante a meiose: os cromossomos que contêm esses genes se separam independentemente.
Conclusão:
A meiose é o processo biológico que permite a separação e combinação independente dos alelos, como descrito na segunda lei de Mendel. A segregação dos cromossomos homólogos durante a meiose I garante que os alelos de genes localizados em cromossomos diferentes sejam herdados independentemente.
A Segunda Lei de Mendel.
A Segunda Lei de Mendel, também conhecida como a Lei da Segregação Independente, foi proposta por Gregor Mendel em seus estudos sobre a herança de características em plantas, especialmente em ervilhas. Essa lei descreve como diferentes pares de alelos segregam (se separam) de maneira independente uns dos outros durante a formação dos gametas. Aqui estão os principais pontos sobre essa lei: